Soluciones
¿Que es una Solución Química?
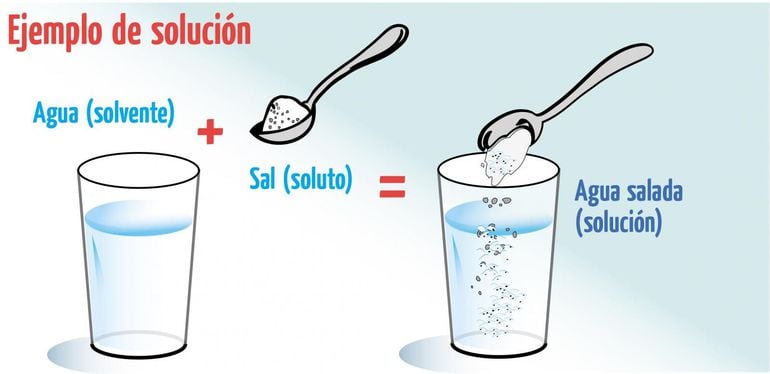
Una solución química es la mezcla homogénea de una o más sustancias disueltas en otra sustancia en mayor proporción. Una solución química es compuesta por soluto y solvente. El soluto es la sustancia que se disuelve y el solvente la que lo disuelve. Las soluciones químicas pueden presentar los tres estados de la materia: líquida, física y gaseosa.
Tipos de Soluciones
⇢ Saturada: Contiene la máxima cantidad de un soluto que se disuelve en un disolvente en particular a una temperatura especifica.
⇢ No Saturada: Contiene menor cantidad de soluto que la que es capaz de disolver.
⇢ Sobresaturada: Contiene más soluto que el que puede haber en una disolución saturada.
⇢ Cristalización: Es el proceso en el cual un soluto disuelto se separa de la disolución y forma cristales.
Factores que afectan a la Disolución
⇢ Presión
⇢ Agitación
⇢ Polaridad
⇢ Temperatura
⇢ Tamaño de Partícula
Reglas de la Solubilidad
1.- Las sales de sodios, potasio y amonio son solubles. Los nitratos, nitritos, cloratos y acetatos son solubles; el nitrito de plata es relativamente poco soluble.
2.- Los óxidos e hidróxidos metálicos son insolubles, excepto los de metales alcalinos (sodio, potasio y también amonio) y el de bario; los óxidos e hidróxidos de estroncio y calcio son relativamente poco solubles.
3.- Los sulfuros son insolubles, excepto los alcalinos, alcalinotérreos (calcio, estroncio, bario) y magnésico.
4.- Los cloruros, bromuros y yoduros son solubles, excepto los de plata, mercurio (I) y plomo; el yoduro de mercurio (II) es también insoluble.
5.- Los fluoruros son insolubles, excepto los alcalinos y los de plata, bismuto, hierro (III) y estaño (IV).
6.- Los sulfatos son solubles excepto los de plomo, barios y estroncio; los sulfatos de calcio y plata son relativamente poco solubles.
7.- Los cromatos son insolubles excepto los alcalinos y los de calcio, magnesio y cinc.
8.- Los carbonatos, sulfitos, arseniatos, arsenitos, boratos y oxalatos son insolubles, excepto los de metales alcalinos. (Las sales insolubles de estos aniones son solubles en ácidos).
⇝ UNIDADES DE CONCENTRACIÓN
Es el estudio cuantitativo de una disolución
requiere que se conozca su concentración,
es decir, la cantidad de soluto presente en
determinada cantidad de disolución.
porcentaje en masa = masa de soluto ∗ 100%
masa de disolución

EJEMPLO
Una masa de 0.892g de KCl se disuelve en 54.6g de agua
¿Cuál es el porcentaje de masa de KCl en la disolución?
% = 0.892ց ∗ 100 = 1.61% ➜ 1.61ց KCl
(0.892ց + 54.6ց) 100ց disolución
⇝ MOLARIDAD (M) Y MOLALIDAD (m)
Molaridad: Es el numero de moles de soluto en 1 Litro de disolución, la unidades de molaridad son moles/L.
M = moles de soluto
litros de disolución
EJEMPLO
Determine la molaridad de una solucion de NaCl si se peso 556ց y el volumen de disolucion fue de 560mL.
M = ? 556ց NaCl ∗ 1 mol NaCl = 9.5124mol NaCl
58.45ց NaCl
450mL ∗ 1L = 0.45 L
1000mL
M = 9.5124mol = 21.1387M NaCl ➝ 21.1387mol NaCl
0.45L 1L de disolución
-----------------------------------------------------------------------------------
Molalidad: Es el numero de moles de soluto disueltos en 1 Kg (1000g) de un disolvente.
m = moles de soluto
masa de disolvente (Kg)
EJEMPLO
Calcule la molalidad de una disolución de ácido sulfúrico que
contiene 24.4g de ácido sulfúrico en 198g de agua.
m = ? 24.4ց H₂SO₄ ∗ 1 mol H₂SO₄ = 0.2488 moles H₂SO₄
98.08ց H₂SO₄
198ց H₂SO₄ ∗ 1 Kg H₂O = 0.198Kg H₂O
1000ց H₂O
m = 0.2488 moles = 1.2566m H₂SO₄ ➝ 1.2566 moles H₂SO₄
0.198Kg 1 Kg de disolvente
------------------------------------------------------------------------------------
⇝ NORMALIDAD
La normalidad en una unidad de concentración que se emplea en los cálculos relativos a los métodos volumétricos. Cuando se trabaja con ácidos y bases se consideran las cantidades de H⁺ y OH⁻ disponibles en la reacción. La normalidad de una disolución se define como el numero de equivalentes-gramo de soluto presentes en un litro de disolución, para designarlo se utiliza la siguiente expresión:
Normalidad (N) = numero de equivalentes-gramo de soluto
Litros de disolución
¿Que es un Equivalente?
Es la cantidad de una sustancia que
representa una unidad de reacción en un
proceso químico en particular. La ventaja de trabajar con equivalentes, es
que las relaciones siempre son de 1:1, al
contrario de cuando se trabaja con moles.
Dado que el concepto de equivalente le
señala como unidad de reacción, el mismo
dependerá del tipo de reacción en el cual la
disolución tome parte.
numero de equivalentes-gramo = peso en gramos de la sustancia
peso equivalente de la sustancia
⇝ Reacciones de Neutralización ⇜
Es la cantidad de sustancia que cede o reacciona con un mol de iones H⁺. Si el soluto es un ácido, n sera la cantidad de iones hidronio que cede, y si el soluto es una base, n sera la cantidad de iones hidronio que es capaz de aceptar.
peso equivalente = peso formula o molecular de la sustancia
n
⇝ Reacciones de Precipitación ⇜
Es la cantidad de sustancia que cede o reacciona con un catión monovalente, n es el numero total de cargas positivas o negativas que tenga una unidad de formula del soluto.
peso equivalente = peso formula o molecular de la sustancia
n
⇝ Reacciones de Oxido Reducción ⇜
Es la cantidad de sustancia que gana o pierde un mol de electrones, n es el numero total de electrones que el soluto gana o pierde en la reacción de oxido-reducción.
peso equivalente = peso formula o molecular de la sustancia
n
⇝ PARTES POR MILLÓN (ppm)
Es una forma de expresar la concentración.
⇢ 1ppm = 1mg/L en disoluciones acuosas, líquidas o gaseosas.
⇢ 1ppm = 1mg/Kg en disoluciones sólidas.
¿Que son las Diluciones?
Es el procedimiento para preparar una disolución menos concentrada a partir de otra mas concentrada. De la solución mas concentrada se toma una pequeña porción que recibe el nombre de alícuota. Esta alícuota lleva una cantidad de moles de soluto. cuanto se agregue mas solvente a la alícuota, la solución estará menos concentrada, sin embargo el numero de moles de la alícuota se conservan.
Sin embargo, no solo es un proceso que se aplica a disoluciones cuya concentración se expresa como molaridad.
C₁V₁ = C₂V₂
EJEMPLO
Cuantos mL de una solución de concentración de 100mg de CO⁺² por mL se necesitan para preparar 1.5L de solución con una concentración de 20mg de CO⁺² por mL.
C₁ = 100mg/mL 丨 C₂ = 20mg/mL
V₁ = ? 丨 V₂ = 1.5L
------------------------------------------------------------------------------
Se despeja la formula inicial ➝ V₁ = C₂V₂
C₁
V₁ = (20mg/mL)(1.5L) = 0.3L
100mg/mL
⇝ PROPIEDADES COLIGATIVAS
Las propiedades coligativas o propiedades colectivas son propiedades que dependen del numero de partículas de soluto en la disolución y no de la naturaleza de las partículas del soluto. Todas estas propiedades tienen un mismo origen, todas dependen del numero de partículas de soluto presentes, independientemente de que sean átomos, iones o moléculas. las propiedades coligativas son la disminución de la presión de vapor, la elevación del punto de ebullición, la disminución del punto de congelación y la presión osmótica.
Disminución de la Presión de Vapor
Si un soluto es no volátil, es decir, no tiene una presión de vapor que se pueda medir, la presión de vapor de sus disoluciones siempre es menor que la del disolvente puro. Así la relación entre la presión de vapor de la disolución y la presión de vapor del disolvente puro depende de la concentración del soluto en la disolución.
Esta relación se expresa por la ley de Raoult, que establece que la presión parcial de un disolvente en una disolución esta dada por la presión de vapor del disolvente puro multiplicada por la fracción molar del disolvente en la disolución.

Elevación del Punto de Ebullición
El punto de ebullición de una disolución es la temperatura a la cual su vapor de presión iguala la presión atmosférica externa. Debido a que la presencia de un soluto no volátil disminuye la presión de vapor de una disolución, también debe afectar el punto de ebullición de la misma.
La elevación del punto de ebullición se define como el punto de ebullición de la disolución menos el punto de ebullición del disolvente puro.
Disminución del Punto de Congelación
La disminución del punto de congelación se define como el punto de congelación del disolvente puro menos el punto de congelación de la disolución.
La explicación cualitativa de la disminución del punto de congelación es la siguiente: La congelación implica la transición de un estado desordenado a un estado ordenado. Para que esto suceda el sistema debe liberar energía. Como en una disolución hay mayor desorden que en el disolvente es necesario que libere mas energía para genera orden que en el caso de un disolvente puro. Por ello la disolución tiene menor punto de congelación que el disolvente.

Presión Osmótica
La presión osmótica de una disolución es la presión que se requiere para detener la ósmosis. La presión osmótica se expresa en atm. Debido a que las mediciones de presión osmótica se llevan a cabo a temperatura constante la concentración se expresa en unidades de molaridad, mas convenientes que las de molalidad.
Al igual que la elevación del punto de ebullición y la disminución del punto de congelación, la presión osmótica es directamente proporcional a la concentración de la disolución. El fenómeno de la presión osmótica se manifiesta en muchas aplicaciones interesantes.
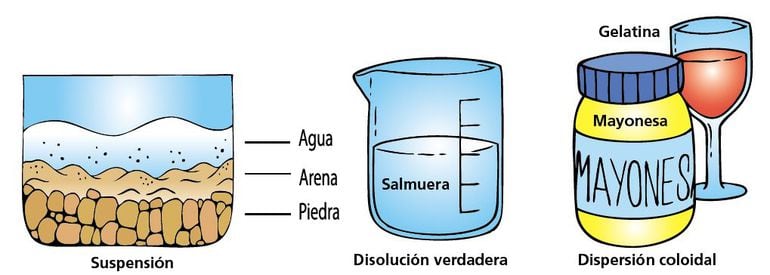
⇝ COLOIDES Y SUSPENSIONES
Un coloide es una dispersión de partículas de una sustancia entre un medio disperso, formado por otra sustancia. Las partículas coloidales son mucho mas grandes que las moléculas de los solutos comunes, miden entre 1x10³ pm a 1x10⁶ pm. Una suspensión coloidal también carece de la homogeneidad de una disolución común. Entre los coloides mas importantes se encuentran aquellos en los que el medio dispersor es el agua, dichos coloides se dividen en dos categorías:
⇢ Los coloides hidrofílicos son disoluciones que contienen moléculas muy grandes, como proteínas.
⇢Los coloides hidrofóbicos no son estables en agua y sus partículas forman conglomerados, como gotas de aceite en agua, que se distribuyen en una película oleosa en la superficie del agua.
Las suspensiones son mezclas heterogéneas formadas por un sólido en polvo o pequeñas partículas no solubles.
Características de las Suspensiones
⇢ Sus partículas son mayores que las soluciones y los coloides, lo que permite observarlas a simple vista.
⇢ Sus partículas se sedimentan si la suspensión se deja en reposo.
⇢ Los componentes de la suspensión pueden separarse por medio de cintrifugación, decantación, filtración y evaporación.
Raymond Chang, (2009), Quimica I.
Comentarios
Publicar un comentario